 发病机制
发病机制
发病机制:目前有相当多的证据支持韦格纳肉芽肿病是一个自身免疫性疾病,ANCA可能参与了血管的激活和损伤。如WG与抗PR3的自身抗体有强的特异关系,抗体效价与临床疾病活动性相关,并可预示复发。疾病对免疫抑制剂治疗反应良好。但也有不支持的依据。尽管在大部分WG病人血清中可检测到抗PR3的特异抗体,但仍有少部分病人ANCA阴性。其次,在受累组织中,既没有发现自身抗体,也没有自身反应性T细胞,没有发现抗PR3的免疫复合物。因此,提示即使ANCA在WG的致病中有一定作用,也不是最基本的作用。
1.ANCA致病机制
(1)ANCA与多形核粒细胞(PMN)之间的反应:PMN在被ANCA激活前需其他炎前因子的启动(primed),在细胞表面表达很多胞浆抗原,包括PR3和MPO,使细胞获得与自身抗体相互作用的靶抗原。已启动的PMN在与ANCA相互作用后,是如何被激活的仍有争论。Kettritz认为细胞表面表达的PR3和MPO之间的交联是激活的基础,因为ANCA的F(ab’)2片段能激活已启动的PMN,而Fab片段则不能。其他作者未能证实上述发现,但发现通过抗体与Fc受体相互作用也可激活PMN,FcγRⅡa和FcγⅢRb均参与了这个过程。另外,针对β2整合素,特别是CD18的封闭抗体能抑制ANCA诱导的PMN激活。
激活的PMN可产生毒性氧基,脱颗粒释放溶酶体酶。另外,它们也可分泌炎症介质如TNFα,IL-1,IL-8和LTB4。激活的PMN黏附分子表达增加,这使PMN易于结合并穿透内皮细胞层。WG病人肾活检标本显示肾小球出现激活的PMN,且激活的PMN数目与肾功能损害的程度相关。此外,激活的PMN也出现于血液循环中,激活的程度与疾病的活动性相关。
(2)ANCA与单核细胞之间的相互作用:ANCA能激活单核细胞,使其毒性氧基,IL-8和MIP-1产生增加。激活前不需要启动,但启动能提高ANCA介导的毒性氧基的产生。
(3)ANCA与内皮细胞之间的关系:内皮细胞是否表达ANCA的靶抗原(特别是PR3)仍有争论。内皮细胞在炎前因子的刺激下,PR3表达增加,并从胞质转位到细胞膜上,使PR3能与ANCA相互作用。PR3-ANCA能诱导内皮细胞黏附分子的上调和IL-1、组织因子的表达。内皮细胞与PR3-ANCA孵育时,内皮细胞合成前列环素、PAF、IL-8增加,蛋白渗漏增加,内皮细胞凋亡、脱落和溶解。
(4)综上所述,参与ANCA相关血管炎的机制如下:
①由于局部感染而释放的细胞因子引起内皮细胞黏附分子的上调,并启动中性粒细胞和(或)单核细胞。
②循环中已启动的中性粒细胞和(或)单核细胞在其细胞表面表达ANCA抗原。
③已启动的中性粒细胞和(或)单核细胞黏附于内皮细胞,随后被ANCA激活。激活的中性粒细胞和(或)单核细胞释放毒性氧基和溶酶体酶,它们导致内皮细胞损伤,最终到坏死性炎症。
④ANCA激活的中性粒细胞和(或)单核细胞脱颗粒释放蛋白酶3和髓过氧化物酶,PR3和MPO使内皮细胞激活、损伤甚至凋亡。其次,已结合抗体的PR3和MPO作为种植抗原,在原位形成免疫复合物,然后再吸引其他中性粒细胞。
⑤ANCA激活的单核细胞产生MCP-1和IL-8,这些趋化物质的释放可扩大单核细胞和中性粒细胞募集的程度,可能导致肉芽肿形成。
2.感染 感染因素也可能导致WG:
(1)很多WG病人的初始症状与感染性疾病相似,病人常常因为呼吸道症状就诊。
(2)在WG病人中进行的支气管肺泡灌洗显示,病人通常表现为中性粒细胞肺泡炎。
(3)已知有几种感染与某些类型的血管炎相关。在人类,血管炎的发生与乙型肝炎、
丙型肝炎、Epstein-Barr病毒、parvo-B19和HIV感染相关。然而仅有不足1%的感染患者发生血管炎,提示宿主的特征决定了疾病的表达。
(4)Subra报告两例患亚急性心内膜炎的病人,C-ANCA均阳性。一例病人经抗生素治疗降低了C-ANCA的效价。另一例病人经抗生素和外科治疗使C-ANCA消失。但某些人认为,将持续感染作为血管炎的刺激剂的理论是站不住脚的:
①直到今天,气道活检标本的组织病理学研究(包括微生物的特殊染色和细菌、抗酸杆菌、真菌、支原体和呼吸道病毒的培养)都没有能够证实致病微生物的存在。
②在乙型肝炎、
丙型肝炎相关血管炎的病人中,应用免疫抑制治疗后,病情虽有显著改善,而他们携带的病毒却明显增加。
近年来,发现韦格纳肉芽肿病与两种特殊的微生物相关:微小病毒(parvovirus)B19和金黄色葡萄球菌。Stegeman发现鼻腔金黄色葡萄球菌的长期带菌与疾病的复发相关。金黄色葡萄球菌携带者复发率为无携带者的8倍。应用TMP/SMX后可降低缓解期病人上气道和鼻腔的复发。葡萄球菌产生的超抗原(SAg)可能是WG的一个重要的触发因子,SAg既可激发自身反应T细胞,也可激活自身反应性B细胞,参与血管炎的病理生理。Finkel在1例WG病人中,发现抗-B19,IgM反应持续近4年,应用巢式PCR证实为病毒血症,静脉注射免疫球蛋白,病人症状显著改善。
3.肉芽肿形成机制 在其他疾病中,肉芽肿通常是由致敏的CD4 T细胞(可产生Thl细胞因子)介导的。在WG中也出现相似的炎症,有一种假说认为,组织损伤和血管炎是否由畸变(不正常)的Thl免疫反应介导的。有几项研究支持这个假说:在WG和相关的血管炎中,细胞因子的产生有定性、定量的异常。在WG病人中,血清IL-1、IL-2、IL-6和TNF-α水平升高,循环单核细胞TNF-α的产生增加。应用反转录聚合酶联反应(RT-PCR)、原位杂交和免疫组化技术发现病人肾小球IL-1和TNF-α的产生增加。最近Ludviksson通过研究活动期WG病人的外周血淋巴细胞,发现与正常人相比,患者CD4 T细胞产生的IFN-γ水平高10~20倍,TNF-α的产生也有显著增加。相反,Th2细胞因子(IL-4、IL-5或IL-10)的水平无显著差异。 Ludviksson还观察到无论是活动期,还是缓解期,病人单核细胞IL-12的产生均增加,而IL-12为T细胞向Th1细胞(可产生IFN-γ)的基本诱导剂。
综上,当WG病人暴露于环境刺激(如感染)和(或)自体抗原诱导的过度巨噬细胞IL-12反应,引起Th1细胞因子(TNF-α、IFN-γ)产生增加,TNF-α、IFN-γ,可启动并维持肉芽肿性血管病变。此过程可被ANCA影响,ANCA可促进中性粒细胞、内皮细胞和单核细胞的激活。
 临床表现
临床表现
临床表现:本病起病缓慢,全身症状有周身不适、疲乏无力、厌食、消瘦和发热。发热常与上呼吸道感染有关,尤其与鼻旁窦继发性感染有关,也可发生在无明显活动性感染的患者,而以本病的一个原发症状出现。约2/3以上的患者以鼻、咽、口腔症状和发热为首发症状,以关节痛、眶内肿物、皮肤、肺、耳受累症状发病较少,偶尔以肾炎为早期表现而无其他系统受累症状,个别患者以原因不明高热为首发症状。2/3以上患者病变原发部位在鼻咽、口腔。原发于关节、皮肤、肺及眼者少见。根据病理特点、发病形式及临床表现,本病可分为周身型和局限型(不完全型),后者又分为3个亚型。
1.周身型
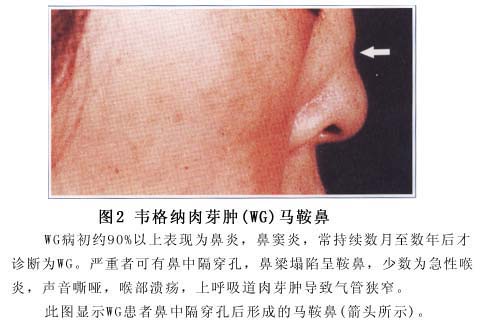
(1)呼吸系统:多数患者以顽固性上呼吸道症状起病。典型临床表现是鼻腔分泌物持续性增多或长期有脓鼻涕,可同时出现鼻黏膜溃疡及鼻旁窦疼痛。典型起病方式以持续性上呼吸道感染或副鼻窦炎为特征,可持续数周到数月。也可表现为严重鼻塞、鼻出血和鼻部疼痛。鼻黏膜破坏后可出现
坏疽性鼻炎。此外还可发生鼻腔黏膜糜烂、坏死,软骨和骨质破坏,常引起
鼻中隔穿孔或由于鼻骨及软骨破坏塌陷而致鞍鼻。有些患者开始无上呼吸道症状,而表现为咳嗽多痰、
咯血、气短、胸痛及胸部不适等下呼吸道症状。个别患者表现为肋间肌疼痛、严重哮喘,伴有
嗜酸粒细胞增多症、一过性肺浸润,听诊时两肺有干、湿性啰音,呈游走性。
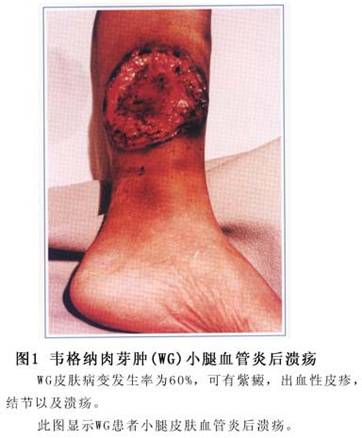
(2)皮肤:约半数患者出现皮肤损害,也是本病的早期表现之一。临床表现不一,可为过敏性血管炎引起的紫癜、瘀斑,也可为丘疹、水疱、缺血性溃疡和皮下结节。皮下结节为坏死性肉芽肿性血管炎的典型特征。有时皮肤损害表现为
渗出性多形性红斑、毛细血管扩张及出血点。上述病变多位于颜面、四肢,尤以关节伸侧多见。病程长者可有色素沉着和瘢痕形成(图1)。
(3)泌尿系统有不同程度的肾脏损害,是本病周身型的常见表现。虽然有些患者可无明显肾病症状,然而一旦出现肾脏损害,且未及时给予妥当治疗,通常可很快发展为急进型肾功能衰竭。临床及尿液检查均无肾炎特征的患者,经肾穿刺活检发现有局灶性肾炎的组织学改变。肾脏损害表现为血尿、蛋白尿,有些患者表现有
肾病综合征的特征,同时伴有大量红细胞管型、透明管型及颗粒管型。继这些改变之后,可出现少尿或无尿,同时伴有肌酐清除率急剧下降及其他肾功能不全的实验室改变。
(4)神经系统:约1/3的患者可出现神经系统表现,系血管炎或肉芽肿损伤所引起的症状,如
昏迷、偏瘫、
蛛网膜下腔出血、脑神经
麻痹、脑脊
髓膜炎、
运动失调和脑干病变等。周围神经受累的表现与典型结节性多动脉炎相同,也是非对称性复合性单神经炎,出现运动和感觉障碍,这是由于神经血管营养障碍所致。
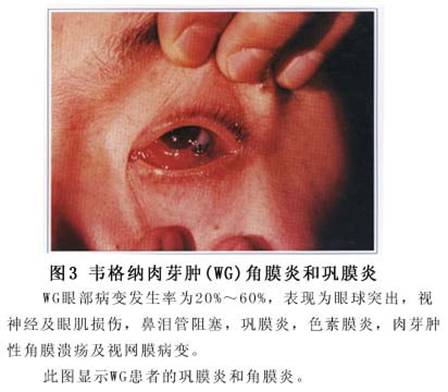
(5)五官:约2/3的患者有眼部症状,其临床特征为自轻度角膜炎到严重巩膜炎不等。有些患者表现为肉芽肿性巩膜、葡萄膜炎,从而可引起巩膜软化窍孔。也可发生继发性眼睑下垂,这是由于鼻旁窦炎症扩散或原发性眶内肉芽肿性血管炎所造成的。还可出现视网膜动脉
血栓形成、鼻泪管阻塞、角膜溃疡及眼部剧痛。浆液性中耳炎也属本病的常见表现,通常是继发于欧氏管阻塞,但也可发生耳结构如鼓膜肉芽肿性破坏。部分患者
耳聋可为本病的始发症状。
(6)其他:部分患者可有胃、十二指肠溃疡,肉芽肿形成,出现不定位的
腹痛、呕血和血便。可有肝、
脾肿大,伴有肝功能异常。
约15%的患者可出现心脏受累,表现为心包炎、全心炎和冠状动脉炎,并可伴有心力衰竭、心肌梗死和顽固性
心律失常等。
多数患者可有关节疼痛,可伴有关节腔积液。关节症状反映了病变的活动性。少数患者还可出现
腮腺炎、睾丸炎和
前列腺炎。
2.局限型
(1)Ⅰ型以上呼吸道与肺部病变为主。以咽部肿痛发病,后咽部可出现多个肿物,表现
吞咽困难、疼痛,有不同程度的出血。两肺可先后出现块状阴影或结节状阴影,表现为咳嗽、多痰、
咯血和胸痛。此型无肾脏病。
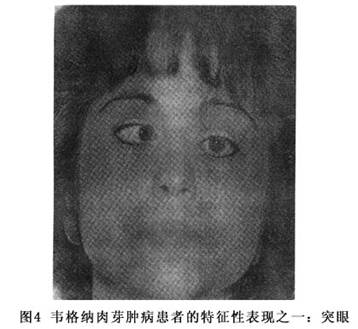
(2)Ⅱ型以鼻、咽、口腔或眼病变为主。常以上呼吸道症状、鼻窦炎或眼部病变为首发症状。眼部病变表现为眶内肿物、突眼和角膜溃疡。临床和病理均易误诊为“眶内炎性假瘤”。关于韦格纳肉芽肿眼部病变与眶内炎性假瘤的鉴别见表1。眼部病变分为两型:①邻接型:多由上呼吸道病变蔓延至眶内形成肉芽肿所致,突眼较重,可有视旁水肿、眼底出血及静脉扩张。②灶型:双侧角膜周缘较典型的潜掘性溃疡,由坏死性血管炎所致的睫状血管闭锁而引起,常有角膜病变(如图2,3,4)。
(3)Ⅲ型:此型以中枢神经系统、皮肤损害或网状内皮系统增生为首发症状,表现为
昏迷、尿失禁、皮疹、高热、肝
脾肿大、全身淋巴结肿大,心脏症状或单纯性肾炎症状。
 鉴别诊断
鉴别诊断
鉴别诊断:必须注意与其他具有肉芽肿性炎症、血管炎疾病相鉴别。
1.肺出血-肾炎综合征 病理学检查示体内存在抗肾小球基底膜抗体及荧光抗体检查有线状排列的IgG,这与韦格纳肉芽肿不同。
2.淋巴瘤样肉芽肿 除无上呼吸道受累外,尚有肾穿刺活检示肾小球淋巴样浸润,这些都可与本病鉴别。
3.特发性中线肉芽肿 是一种面部和上呼吸道局部破坏疾病,通过肾脏穿刺活检可与本病鉴别。
4.其他韦格纳肉芽肿 伴有
嗜酸粒细胞增多症时,还应注意与引起嗜酸粒细胞增多的许多原发病相鉴别,尤其应与过敏性肉芽肿相鉴别,后者以发热、发作性哮喘、嗜酸粒细胞增多为特征,其组织病理改变主要为嗜酸粒细胞浸润,病灶周围类上皮细胞呈放射状排列,受累的血管为中、小动脉,微动脉,静脉与毛细血管,无副鼻窦炎的临床表现和X线特征。另外,韦格纳肉芽肿的肺部症状及X线特征也与过敏性肉芽肿有显著不同。
 治疗
治疗
治疗:病变原发部位在上呼吸道时,利用X线局部照射可控制局部损害。糖皮质激素可缓解症状及延长患者寿命,其剂量、给药方式和药物品种与典型结节性多动脉炎相同。近年来,利用免疫抑制剂治疗本病取得了较好效果,尤其是肾功能衰竭时,每天联合应用硫唑嘌呤200mg和环孢素(环孢霉素A) 0.5mg/d,据报道效果更好。也有人应用
甲氧苄啶(
复方新诺明)治疗伴有上呼吸道炎症的WG取得了较好的疗效。用生物碱如长春新碱与烷化剂环磷酰胺联合化疗,较单用糖皮质激素缓解症状快,而且停药后复发也慢。另外,在病情活动期联合应用糖皮质激素与环磷酰胺,也较单用糖皮质激素效果好得多。还可用其他抗风湿药物如阿司匹林、
保泰松、
抗风湿灵等,以作为激素或细胞毒类药物的辅助治疗。必须注意在化疗过程中所造成的继发感染。当鼻旁窦有继发感染时,应及时进行上颔窦穿刺,并给予有效的抗生素控制感染。
1.西医治疗
(1)皮质类固醇激素:常用泼尼松(强的松)每天1~2mg/kg,症状缓解后改为隔日早晨顿服方法维持,适用于局灶型WG病例,如合并肾炎,或单纯激素治疗不敏感者,改用或加用免疫抑制剂。
(2)免疫抑制剂:①环磷酰胺:每天1~2mg/kg;②硫唑嘌呤:每天2mg/kg;③联合用药:泼尼松 环磷酰胺 硫唑嘌呤联合序贯应用。
免疫抑制剂的治疗注意点:①定期检查血象,如白细胞<3×109/L,应停药;②免疫抑制剂需在出现肾功能衰竭前应用,一旦出现肾功能衰竭,治疗仍需借助血液透析与肾移植;③免疫抑制剂有效病例需维持治疗1年以上方可逐渐停药。
(3)
甲氧苄啶:据个别作者报道
甲氧苄啶可使WG病情长期缓解,可能是有助控制感染因素,但有人认为,可在选择的病例中应用而不应普遍推荐。
2.中医治疗
治则:热毒阻络,宜清热解毒,活血化瘀;气血虚弱,血瘀阻络,宜益气养血,祛邪通络;气滞血瘀,行气活血通络;肝肾阴虚,肝阳上亢,宜滋阴潜阳,活血化瘀。
常用方剂:①四妙勇安汤加味;②参芪桂枝五物汤加昧;③血府逐瘀汤加减;④镇肝熄风汤加减。
辨证诊治经验方如下。①回阳建中方:主药有附子(先煎),当归,白芍,
丹参,苍术,茯苓,川芎,陈皮,鸡血藤,枸杞,厚朴,独活,木香;②温阳益气方:主药有附子,肉桂,党参,菟丝子,山萸肉,太子参,炙甘草,当归,川芎,红花,怀山药,玄参,红花,桃仁,
丹参,沙参,麦冬,磁石英,白芍,香附,干姜,五味子,细辛,黄芪。
临床不少报道认为,WG在应用皮质类固醇激素和(或)免疫抑制剂的同时,辨证加用中药治疗疗效显著提高。
3.护理
(1)护理问题:
①疼痛、感染。
②眼部损害。
③其他系统损害。
(2)护理目标:
①减轻疼痛、控制感染。
②防止及减轻眼部不适。
③加强营养、增强体质。
④预防其他系统损害。
(3)护理措施:
①给予支持疗法,加强营养,输血,增强体质,控制感染。
②根据感染情况,采用不同的抗生素,以控制感染。受损部位可用理疗方法如局部热敷、超短波、红外线等促使炎症消退,改善症状。缓解鼻窦炎症状,可用头低体位引流法,促进分泌物引流,控制感染。其方法:先用1%麻黄素生理盐水滴入鼻内,使其黏膜收缩,窦口通畅,以利引流;病人取坐位,下肢分开,上身下俯,头垂近膝,便于窦内脓液排入鼻腔。
③定期检查视力,了解对眼部累及情况。注意眼部清洁,及时清除内眦分泌物。眼球突出者,应注意避免角膜干燥、受损和感染。室外活动需戴防护眼镜,避免风沙刺激。经常冲洗结膜囊和滴眼药水,睡前应涂眼膏、带眼罩防护。
④做好临床观察,防止其他系统发生损害。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
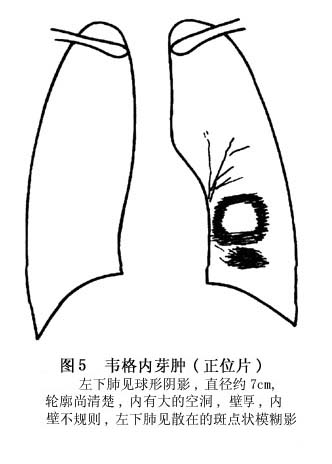
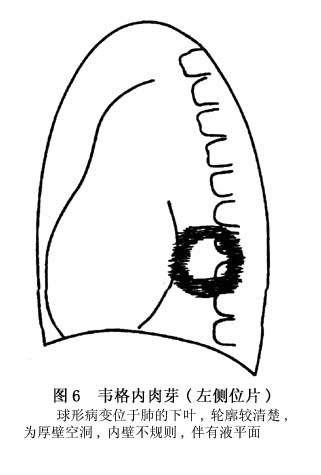
 诊断
诊断

 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防